Gas nobili

I gas nobili (anche detti gas rari) sono dei gas inerti che costituiscono il diciottesimo[1] gruppo della tavola periodica degli elementi, cioè la colonna più a destra. Sono costituiti da atomi con gusci elettronici completi. Ne fanno parte i seguenti elementi:
Talvolta essi (particolarmente l'elio) si trovano insieme ad altri gas (per lo più azoto e metano) in sorgenti endogene; l'elio di origine endogena proviene dalla decomposizione di elementi radioattivi presenti nel sottosuolo che emettono particelle α (cioè ioni He2+): queste ossidano specie presenti nel terreno e diventano atomi di elio.
I gas nobili sono tutti gas monoatomici, non facilmente liquefacibili, presenti nell'atmosfera in percentuali varie; il più comune è l'argo che ne costituisce circa lo 0,932%.
Caratteristiche
| Elemento | Elio (3He e 4He) | Neon | Argon | Kripton | Xenon | Radon | |
|---|---|---|---|---|---|---|---|
| Punto di fusione Errore in {{M}}: parametro 1 non è un numero valido.)[2] | 0,319 Errore in {{M}}: parametro 1 non è un numero valido.) (29,315 bar) |
0,775 K (−272,375 °C) (25,316 bar) |
24,57 K (−248,58 °C) |
84,0 K (−189,2 °C) |
116,2 K (−157,0 °C) |
161,4 K (−111,8 °C) |
ca. 202 K (ca. −71 °C) |
| Punto di ebollizione (1013 hPa)[2] | 3,1905 K (−269,9595 °C) |
4,224 K (−268,926 °C) |
27,09 K (−246,06 °C) |
87,295 K (−185,855 °C) |
119,79 K (−153,36 °C) |
165,03 K (−108,12 °C) |
211,9 K[3] (−61,3 °C) |
| Punto critico[2] |
|
|
|
|
|
|
|
| Punto triplo[2] | inesistente |
|
|
|
|
||
| Densità (0 °C, 1013 hPa)[2] | 0,13448 kg/m³ | 0,17847 kg/m³ | 0,9000 kg/m³ | 1,7839 kg/m³ | 3,7493 kg/m³ | 5,8971 kg/m³ | 9,73 kg/m³ |
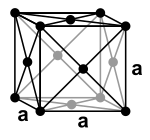
| Struttura |  |
 |
 |
 |
 |

| |
| Sistema cristallino | esagonale | cubico | cubico | cubico | cubico | cubico | |
| Costante di reticolo[4] |
|
a = 4,43 Å |
a = 5,26 Å |
a = 5,72 Å |
a = 6,20 Å |
a = 6,55 Å[5] | |
Cenni storici

Il termine gas nobili deriva dal fatto che essi evitano di reagire con gli elementi "comuni", esibendo un atteggiamento attribuito comunemente alla "nobiltà". I gas nobili venivano anche chiamati gas inerti, ma il termine non era accurato, in quanto alcuni di essi hanno mostrato di prendere parte in reazioni chimiche.
A causa della loro non-reattività, i gas nobili non furono scoperti fin quando l'esistenza dell'elio non fu dedotta ipoteticamente da un'analisi spettrografica del Sole, e successivamente provata quando William Ramsay riuscì a isolarlo. I gas nobili hanno inoltre forze di attrazione interatomica molto deboli e conseguentemente punti di fusione ed ebollizione molto bassi.
Gli atomi più grossi della serie sono leggermente più reattivi, e lo xeno è stato indotto a formare un numero di composti con il fluoro e con l'ossigeno. Nel 1962, Neil Bartlett, mentre lavorava alla University of British Columbia, fece reagire lo xeno con il fluoro ottenendo XeF2, XeF4, e XeF6. Il radon reagisce con il fluoro formando fluoruro di radon, RnF, e il composto, allo stato solido, emette una luce gialla. Anche il kripton reagisce con il fluoro formando KrF2. Nel 2003 è stato scoperto che anche l'argon forma composti come ad esempio il fluoruro di argo ArF2.
Nel 2002, vennero scoperti composti dove l'uranio formava molecole con argon, kripton, o xeno. Ciò suggerisce che i gas nobili potrebbero formare composti anche con altri metalli.
Proprietà chimiche
I gas nobili sono incolori, inodori, insapori, e non infiammabili nelle condizioni standard. Una volta appartenevano al gruppo 0 della tavola periodica poiché si credeva che questi avessero una valenza pari a 0, il che li impossibilitava a combinarsi con altri elementi per formare composti. Tuttavia si è poi scoperto che alcuni gas nobili riescono a formare composti, il che ha fatto cadere in disuso questa denominazione.
Così come gli altri gruppi, anche i gas nobili hanno una periodicità per quanto riguarda la configurazione elettronica.
| Z | Elemento | N. di elettroni/Livelli energetici |
|---|---|---|
| 2 | elio | 2 |
| 10 | neon | 2, 8 |
| 18 | argon | 2, 8, 8 |
| 36 | krypton | 2, 8, 18, 8 |
| 54 | xenon | 2, 8, 18, 18, 8 |
| 86 | radon | 2, 8, 18, 32, 18, 8 |
I gas nobili hanno il livello elettronico esterno completo; di conseguenza sono estremamente stabili e quindi non tendono a formare legami chimici con altri elementi, in concordanza con quanto enunciato dalla regola dell'ottetto.
Luminescenza

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
| Elio | Neon | Argon | Krypton | Xenon |
Note
- ^ I gas nobili appartengono al diciottesimo gruppo della tavola periodica secondo l'attuale nomenclatura IUPAC, mentre secondo la vecchia nomenclatura appartengono al gruppo VIIIA.
- ^ a b c d e P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (DOI: 10.1002/14356007.a17_485).
- ^ a b c d e A. G. M. Ferreira, L. Q. Lobo: On the vapour pressure of radon. In: The Journal of Chemical Thermodynamics. 2007, 39, 10, S. 1404–1406, DOI: 10.1016/j.jct.2007.03.017
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, 30, S. 193–204, DOI: 10.1107/S0567740874002469.
- ^ A. V. Grosse: Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em). In: Journal of Inorganic and Nuclear Chemistry. 1965, 27, 3, S. 509–519, DOI: 10.1016/0022-1902(65)80255-X.
Voci correlate
Altri progetti
Wikiquote contiene citazioni di o su gas nobili
Wikimedia Commons contiene immagini o altri file sui gas nobili
Collegamenti esterni
| Controllo di autorità | Thesaurus BNCF 19753 · LCCN (EN) sh85053403 · GND (DE) 4151020-3 · BNF (FR) cb11982013b (data) · J9U (EN, HE) 987007560587305171 · NDL (EN, JA) 01030643 |
|---|
Template:Link AdQ Template:Link AdQ Template:Link AdQ Template:Link AdQ Template:Link AdQ