Proteina
Proteinat janë biomolekula dhe makromolekula të mëdha që përfshijnë një ose më shumë zinxhirë të gjatë mbetjesh aminoacide. Proteinat kryejnë një sërë funksionesh brenda organizmave, duke përfshirë katalizimin e reaksioneve metabolike, replikimin e ADN-së, reagimin ndaj stimujve,sigurimin e strukturës për qelizat dhe organizmat dhe transportimin e molekulave nga një vend në tjetrin. Proteinat ndryshojnë nga njëra-tjetra kryesisht në sekuencën e tyre të aminoacideve, e cila diktohet nga sekuenca nukleotide e gjeneve të tyre dhe që zakonisht rezulton në palosjen e proteinave në një strukturë specifike 3D që përcakton aktivitetin e saj.

Një zinxhir linear i mbetjeve të aminoacideve quhet polipeptid. Një proteinë përmban të paktën një polipeptid të gjatë. Polipeptidet e shkurtra, që përmbajnë më pak se 20-30 mbetje, rrallë konsiderohen si proteina dhe zakonisht quhen peptide, ose ndonjëherë oligopeptide. Mbetjet individuale të aminoacideve janë të lidhura së bashku nga lidhjet peptide dhe mbetjet e aminoacideve ngjitur. Sekuenca e mbetjeve të aminoacideve në një proteinë përcaktohet nga sekuenca e një gjeni, i cili është i koduar në kodin gjenetik. Në përgjithësi, kodi gjenetik specifikon 20 aminoacide standarde; por në disa organizma kodi gjenetik mund të përfshijë selenocisteinën dhe - në arkea të caktuara - pirolizinën. Menjëherë pas ose edhe gjatë sintezës, mbetjet në një proteinë shpesh modifikohen kimikisht nga modifikimi pas përkthimit, i cili ndryshon vetitë fizike dhe kimike,palosjen, stabilitetin, aktivitetin dhe në fund të fundit funksionin e proteinave. Disa proteina kanë grupe jo-peptide të bashkangjitura, të cilat mund të quhen grupe protetike ose kofaktorë. Proteinat gjithashtu mund të punojnë së bashku për të arritur një funksion të caktuar, dhe ato shpesh shoqërohen për të formuar komplekse të qëndrueshme proteinike.
-Pasi të formohen, proteinat ekzistojnë vetëm për një periudhë të caktuar dhe më pas degradohen dhe riciklohen nga makineria e qelizës përmes procesit të qarkullimit të proteinave. Jetëgjatësia e një proteine matet në termat e gjysmë-jetës së saj dhe mbulon një gamë të gjerë. Ato mund të ekzistojnë për minuta ose vite me një jetëgjatësi mesatare prej 1-2 ditësh në qelizat e gjitarëve.Proteinat jonormale ose të palosura keq degradohen më shpejt ose për shkak të synimit përshkatërrim ose për shkak të paqëndrueshmërisë. -Ashtu si makromolekulat e tjera biologjike si polisakaridet dhe acidet nukleike, proteinat janë pjesë thelbësore e organizmave dhe marrin pjesë praktikisht në çdo proces brenda qelizave. Shumë proteina janë enzima që katalizojnë reaksionet biokimike dhe janë jetike për metabolizmin. Proteinat gjithashtu kanë funksione strukturore ose mekanike, të tilla si aktina dhe miozina në muskuj dhe proteinat në citoskelet, të cilat formojnë një sistem skele që ruan formën e qelizave. Proteinat e tjera janë të rëndësishme në sinjalizimin e qelizave, përgjigjet imune, ngjitjen e qelizave dhe ciklin qelizor. Tek kafshët, proteinat janë të nevojshme në dietë për të siguruar aminoacidet thelbësore që nuk mund të sintetizohen.
-Proteinat mund të pastrohen nga përbërës të tjerë qelizorë duke përdorur një sërë teknikash si ultracentrifugimi, precipitimi, elektroforeza dhe kromatografia; ardhja e inxhinierisë gjenetike ka bërë të mundur një sërë metodash për të lehtësuar pastrimin. Metodat që përdoren zakonisht për të studiuar strukturën dhe funksionin e proteinave përfshijnë imunohistokiminë, mutagjenezën e drejtuar nga vendi, kristalografinë me rreze X, rezonancën magnetike bërthamore dhe spektrometrinë e masës.
Historia dhe etimologjia
[Redakto | Redakto nëpërmjet kodit]Proteinat u njohën si një klasë e veçantë e molekulave biologjike në shekullin e tetëmbëdhjetë nga Antoine Fourcroy dhe të tjerë, të dalluara nga aftësia e molekulave për të mpiksur ose flokuluar nën trajtimet me nxehtësi ose acid. Shembujt e përmendur në atë kohë përfshinin albuminën nga të bardhat e vezëve, albuminën e serumit të gjakut, fibrinën dhe glutenin e grurit. Proteinat u përshkruan për herë të parë nga kimisti holandez Gerardus Johannes Mulder dhe u emëruan nga kimisti suedez Jöns Jacob Berzelius në 1838.Mulder kreu analiza elementare të proteinave të zakonshme dhe zbuloi se pothuajse të gjitha proteinat kishin të njëjtën formulë empirike, C400H620N100O120P1S1.Ai arriti në përfundimin e gabuar se ato mund të përbëhen nga një lloj molekule (shumë e madhe). Termi "proteinë" për të përshkruar këto molekula u propozua nga bashkëpunëtori i Mulder's Berzelius; proteina rrjedh nga fjala greke πρώτειος (proteios), që do të thotë "primare", "në krye", ose "qëndrimi përpara", + -in. Mulder vazhdoi të identifikonte produktet e degradimit të proteinave si aminoacidi leucinë për të cilin ai gjeti një peshë molekulare (pothuajse të saktë) prej 131 Da. Përpara "proteinës", u përdorën emra të tjerë, si "albuminat" ose "materialet albuminoze" (Eiweisskörper, në gjermanisht).
Shkencëtarët e hershëm të ushqyerjes si gjermani Carl von Voit besonin se proteina ishte lëndë ushqyese më e rëndësishme për ruajtjen e strukturës së trupit, sepse përgjithësisht besohej se "mishi bën mish."Karl Heinrich Ritthausen zgjeroi format e njohura të proteinave me identifikimi i acidit glutamik. Në Stacionin e Eksperimentit Bujqësor të Konektikatit një përmbledhje e detajuar e proteinave bimore u përpilua nga Thomas Burr Osborne. Duke punuar me Lafayette Mendel dhe duke zbatuar ligjin e Liebig për minimumin në ushqimin e minjve laboratorikë, u krijuan aminoacidet thelbësore ushqyese. Puna u vazhdua dhe u komunikua nga William Cumming Rose. Kuptimi i proteinave si polipeptide erdhi përmes punës së Franz Hofmeister dhe Hermann Emil Fischer në 1902. Roli qendror i proteinave si enzima në organizmat e gjallë nuk u vlerësua plotësisht deri në vitin 1926, kur James B. Sumner tregoi se enzima ureaza ishte në fakt një proteinë.
Vështirësia në pastrimin e proteinave në sasi të mëdha i bëri ato shumë të vështira për t'i studiuar biokimistët e hershëm të proteinave. Prandaj, studimet e hershme u fokusuan në proteinat që mund të pastroheshin në sasi të mëdha, p.sh., ato të gjakut, të bardhët e vezës, toksina të ndryshme dhe enzimat tretëse/metabolike të marra nga thertoret. Në vitet 1950, Armor Hot Dog Co. pastroi 1 kg ribonukleazë të pastër pankreatike të gjedhit A dhe e bëri atë lirisht të disponueshme për shkencëtarët; Ky gjest ndihmoi ribonukleazën A të bëhej një objektiv kryesor për studimin biokimik për dekadat në vijim.
John Kendrew me modelin e mioglobinës në progres Linus Pauling vlerësohet me parashikimin e suksesshëm të strukturave dytësore të rregullta të proteinave të bazuara në lidhjen e hidrogjenit, një ide e paraqitur për herë të parë nga William Astbury në 1933. Puna e mëvonshme nga Walter Kauzmann mbi denatyrimin,e bazuar pjesërisht në studimet e mëparshme nga Kaj Linderstrøm-Lang,kontribuoi në një kuptim të palosjes dhe strukturës së proteinave të ndërmjetësuara nga ndërveprimet hidrofobike.
Proteina e parë që u rendit ishte insulina, nga Frederick Sanger, në 1949. Sanger përcaktoi saktë sekuencën e aminoacideve të insulinës, duke demonstruar kështu përfundimisht se proteinat përbëheshin nga polimere lineare të aminoacideve në vend të zinxhirëve të degëzuar, koloideve ose cikoleve. Ai fitoi çmimin Nobel për këtë arritje në vitin 1958.
Strukturat e para të proteinave që u zgjidhën ishin hemoglobina dhe mioglobina, nga Max Perutz dhe Sir John Cowdery Kendrew, përkatësisht, në 1958. Që nga viti 2017, Protein Data Bank ka mbi 126,060 struktura proteinash me rezolucion atomik. Në kohët më të fundit, mikroskopi krio-elektronik i asambleve të mëdha makromolekulare dhe parashikimi i strukturës llogaritëse të proteinave të domeneve të vogla proteinike janë dy metoda që i afrohen zgjidhjes atomike.
Numri i proteinave të koduara në gjenom
[Redakto | Redakto nëpërmjet kodit]Numri i proteinave të koduara në një gjenom përafërsisht korrespondon me numrin e gjeneve (megjithëse mund të ketë një numër të konsiderueshëm gjenesh që kodojnë ARN-në e proteinës, p.sh. ARN ribozomale). Viruset zakonisht kodojnë disa deri në disa qindra proteina, arkeat dhe bakteret nga disa qindra deri në disa mijëra, ndërsa eukariotët zakonisht kodojnë disa mijëra deri në dhjetëra mijëra proteina (shih madhësinë e gjenomit për një listë shembujsh).
Biokimia
[Redakto | Redakto nëpërmjet kodit]Shumica e proteinave përbëhen nga polimere lineare të ndërtuara nga një seri deri në 20 aminoacide të ndryshme L-α. Të gjitha aminoacidet proteinogjene kanë karakteristika të përbashkëta strukturore, duke përfshirë një α-karbon me të cilin lidhen një grup amino, një grup karboksil dhe një zinxhir anësor të ndryshueshëm. Vetëm prolina ndryshon nga kjo strukturë bazë pasi përmban një unazë të pazakontë në grupin e aminës N-fund, i cili detyron pjesën e amidit CO-NH në një konformacion fiks.Zinxhirët anësore të aminoacideve standarde, të detajuara në listën e aminoacideve standarde, kanë një larmi të madhe strukturash dhe vetive kimike; është efekti i kombinuar i të gjithë vargjeve anësore të aminoacideve në një proteinë që në fund të fundit përcakton strukturën e saj tredimensionale dhe reaktivitetin e saj kimik. Aminoacidet në një zinxhir polipeptid janë të lidhur me lidhje peptide. Pasi të lidhet në zinxhirin proteinik, një aminoacid individual quhet mbetje dhe seria e lidhur e atomeve të karbonit, azotit dhe oksigjenit njihet si zinxhiri kryesor ose shtylla e proteinës: 19.
Lidhja peptide ka dy forma rezonance që kontribuojnë në një karakter të lidhjes së dyfishtë dhe pengojnë rrotullimin rreth boshtit të saj, në mënyrë që karbonet alfa të jenë afërsisht koplanare. Dy këndet e tjera dihedrale në lidhjen peptide përcaktojnë formën lokale të marrë nga shtylla kurrizore e proteinës. grupi i lirë karboksil njihet si fundi C ose fundi karboksi (sekuenca e proteinës shkruhet nga fundi N në fundin C, nga e majta në të djathtë).
Fjalët proteinë, polipeptid dhe peptid janë paksa të paqarta dhe mund të mbivendosen në kuptim. Proteina në përgjithësi përdoret për t'iu referuar molekulës së plotë biologjike në një konformacion të qëndrueshëm, ndërsa peptidi përgjithësisht rezervohet për një oligomer të shkurtër të aminoacideve që shpesh u mungon një strukturë e qëndrueshme 3D. Por kufiri midis të dyjave nuk është i përcaktuar mirë dhe zakonisht shtrihet afër 20-30 mbetjeve.Polipeptidi mund t'i referohet çdo zinxhiri të vetëm linear të aminoacideve, zakonisht pavarësisht nga gjatësia, por shpesh nënkupton mungesën e një konformacioni të përcaktuar.
Ndërveprimet
[Redakto | Redakto nëpërmjet kodit]Proteinat mund të ndërveprojnë me shumë lloje të molekulave, duke përfshirë me proteina të tjera, me lipide, me karbohidrate dhe me ADN-në.[27][28][25][29]
Bollëk në qeliza
[Redakto | Redakto nëpërmjet kodit]Është vlerësuar se bakteret me madhësi mesatare përmbajnë rreth 2 milionë proteina për qelizë (p.sh. E. coli dhe Staphylococcus aureus). Bakteret më të vogla, të tilla si Mycoplasma ose spiroketat përmbajnë më pak molekula, nga 50,000 deri në 1 milion. Në të kundërt, qelizat eukariote janë më të mëdha dhe kështu përmbajnë shumë më tepër proteina. Për shembull, qelizat e majave janë vlerësuar të përmbajnë rreth 50 milionë proteina dhe qeliza njerëzore nga 1 deri në 3 miliardë.[30] Përqendrimi i kopjeve individuale të proteinave varion nga disa molekula për qelizë deri në 20 milionë.[31] Jo të gjitha gjenet që kodojnë proteinat shprehen në shumicën e qelizave dhe numri i tyre varet, për shembull, nga lloji i qelizave dhe nga stimujt e jashtëm. Për shembull, nga rreth 20,000 proteina të koduara nga gjenomi njerëzor, vetëm 6,000 zbulohen në qelizat limfoblastoide.
Sinteza
[Redakto | Redakto nëpërmjet kodit]Biosinteza
[Redakto | Redakto nëpërmjet kodit]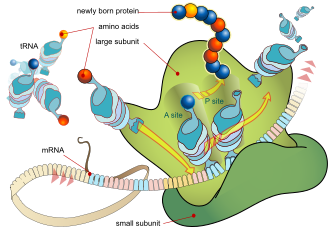

Proteinat grumbullohen nga aminoacidet duke përdorur informacionin e koduar në gjene. Çdo proteinë ka sekuencën e saj unike të aminoacideve që specifikohet nga sekuenca nukleotide e gjenit që kodon këtë proteinë. Kodi gjenetik është një grup grupesh me tre nukleotide të quajtura kodone dhe çdo kombinim me tre nukleotide përcakton një aminoacid, për shembull AUG (adeninë-uracil-guaninë) është kodi për metioninën. Për shkak se ADN-ja përmban katër nukleotide, numri i përgjithshëm i kodoneve të mundshëm është 64; prandaj, ka një tepricë në kodin gjenetik, me disa aminoacide të specifikuara nga më shumë se një kodon. . Shumica e organizmave më pas përpunojnë pre-mRNA-në (e njohur edhe si transkript primar) duke përdorur forma të ndryshme të modifikimit post-transkriptues për të formuar mARN-në e pjekur, e cila më pas përdoret si shabllon për sintezën e proteinave nga ribozomi. Në prokariotët, mARN mund të përdoret sapo të prodhohet, ose të lidhet nga një ribozom pasi të jetë larguar nga nukleoidi. Në të kundërt, eukariotët krijojnë mRNA në bërthamën e qelizës dhe më pas e zhvendosin atë nëpër membranën bërthamore në citoplazmë, ku më pas ndodh sinteza e proteinave. Shkalla e sintezës së proteinave është më e lartë te prokariotët sesa eukariotët dhe mund të arrijë deri në 20 aminoacide në sekondë.
Procesi i sintetizimit të një proteine nga një shabllon mRNA njihet si përkthim. ARNi ngarkohet në ribozom dhe lexohet tre nukleotide në të njëjtën kohë duke përputhur çdo kodon me antikodonin e tij të çiftëzimit bazë të vendosur në një molekulë të ARN-së transferuese, e cila mbart aminoacidin që korrespondon me kodonin që ajo njeh. Enzima aminoacil tRNA sintetaza "ngarkon" molekulat e tRNA me aminoacidet e duhura. Polipeptidi në rritje shpesh quhet zinxhiri i lindjes. Proteinat biosintetizohen gjithmonë nga fundi N në C-terminus.
Madhësia e një proteine të sintetizuar mund të matet nga numri i aminoacideve që përmban dhe nga masa e saj totale molekulare, e cila normalisht raportohet në njësi dalton (sinonim me njësitë e masës atomike), ose njësia derivatore kilodalton (kDa). Madhësia mesatare e një proteine rritet nga Archaea në Bakteret në Eukariote (283, 311, 438 mbetje dhe 31, 34, 49 kDa respektivisht) për shkak të një numri më të madh të domeneve të proteinave që përbëjnë proteinat në organizmat më të lartë.Për shembull, proteinat e majave janë mesatarisht 466 aminoacide të gjata dhe 53 kDa në masë.Proteinat më të mëdha të njohura janë titinet, një përbërës i sarkomerit të muskujve, me një masë molekulare prej gati 3000 kDa dhe një gjatësi totale prej gati 27000 aminoacide.
Sinteza kimike
[Redakto | Redakto nëpërmjet kodit]Proteinat e shkurtra mund të sintetizohen gjithashtu kimikisht nga një familje metodash të njohura si sinteza e peptideve, të cilat mbështeten në teknikat e sintezës organike si lidhja kimike për të prodhuar peptide me rendiment të lartë.[36] Sinteza kimike lejon futjen e aminoacideve jo-natyrore në zinxhirët polipeptidë, si p.sh. lidhja e sondave fluoreshente në zinxhirët anësor të aminoacideve.[37] Këto metoda janë të dobishme në biokiminë laboratorike dhe biologjinë qelizore, megjithëse në përgjithësi jo për aplikime komerciale. Sinteza kimike është joefikase për polipeptidet më të gjata se rreth 300 aminoacide dhe proteinat e sintetizuara mund të mos marrin lehtësisht strukturën e tyre terciare. Shumica e metodave të sintezës kimike kalojnë nga fundi C në fundin N, përballë reaksionit biologjik.
Struktura
[Redakto | Redakto nëpërmjet kodit]


Shumica e proteinave palosen në struktura unike 3D. Forma në të cilën një proteinë paloset natyrshëm njihet si konformimi i saj vendas. Edhe pse shumë proteina mund të palosen të pandihmuara, thjesht nëpërmjet vetive kimike të aminoacideve të tyre, të tjerat kërkojnë ndihmën e kaperonëve molekularë që të palosen në gjendjen e tyre amtare.Biokimistët shpesh i referohen katër aspekteve të veçanta të strukturës së një proteine.
- Struktura primare: sekuenca e aminoacideve. Një proteinë është një poliamid.
- Struktura dytësore: struktura lokale që përsëriten rregullisht të stabilizuara nga lidhjet hidrogjenore. Shembujt më të zakonshëm janë α-spiralja, fleta β dhe kthesat. Për shkak se strukturat sekondare janë lokale, shumë rajone me strukturë dytësore të ndryshme mund të jenë të pranishme në të njëjtën molekulë proteine. Struktura terciare: forma e përgjithshme e një molekule të vetme proteine; marrëdhëniet hapësinore të strukturave dytësore me njëra-tjetrën.
- Struktura terciare përgjithësisht stabilizohet nga ndërveprimet jolokale, më së shpeshti nga formimi i një bërthame hidrofobike, por edhe nëpërmjet urave të kripës, lidhjeve hidrogjenore, lidhjeve disulfide dhe madje edhe modifikimeve pas përkthimit. Termi "strukturë terciare" përdoret shpesh si sinonim me termin fold. Struktura terciare është ajo që kontrollon funksionin bazë të proteinës.
- Struktura kuaternare: struktura e formuar nga disa molekula proteinike (zinxhirë polipeptide), zakonisht të quajtura nënnjësi proteinike në këtë kontekst, të cilat funksionojnë si një kompleks i vetëm proteinik.
- Struktura kuinare: nënshkrimet e sipërfaqes së proteinave që organizojnë brendësinë e mbushur me njerëz. Struktura kuinare varet nga ndërveprimet kalimtare, por thelbësore, makromolekulare që ndodhin brenda qelizave të gjalla. Proteinat nuk janë molekula tërësisht të ngurta. Përveç këtyre niveleve të strukturës, proteinat mund të zhvendosen midis disa strukturave të lidhura ndërsa ato kryejnë funksionet e tyre. Në kontekstin e këtyre rirregullimeve funksionale, këto struktura terciare ose kuaternare zakonisht quhen "konformacione" dhe kalimet ndërmjet tyre quhen ndryshime konformacionale. Ndryshime të tilla shpesh shkaktohen nga lidhja e një molekule të substratit në zonën aktive të një enzime, ose në rajonin fizik të proteinës që merr pjesë në katalizën kimike. Në tretësirë, proteinat gjithashtu pësojnë ndryshime në strukturë përmes dridhjeve termike dhe përplasjes me molekulat e tjera.
Proteinat mund të ndahen joformalisht në tre klasa kryesore, të cilat lidhen me strukturat tipike terciare: proteinat globulare, proteinat fibroze dhe proteinat e membranës. Pothuajse të gjitha proteinat globulare janë të tretshme dhe shumë janë enzima. Proteinat fibroze janë shpesh strukturore, si kolagjeni, përbërësi kryesor i indit lidhës, ose keratina, përbërësi proteinik i flokëve dhe thonjve. Proteinat e membranës shpesh shërbejnë si receptorë ose ofrojnë kanale që molekulat polare ose të ngarkuara të kalojnë nëpër membranën qelizore.165–85. Një rast i veçantë i lidhjeve intramolekulare të hidrogjenit brenda proteinave, të mbrojtura dobët nga sulmi i ujit dhe si rrjedhim duke nxitur dehidratimin e tyre, quhen dehidrone.
Domenet e proteinave
[Redakto | Redakto nëpërmjet kodit]Shumë proteina përbëhen nga disa fusha proteinash, d.m.th. segmente të një proteine që palosen në njësi strukturore të dallueshme. Domenet zakonisht kanë edhe funksione specifike, të tilla si aktivitetet enzimatike (p.sh. kinaza) ose ato shërbejnë si module lidhëse (p.sh. domeni SH3 lidhet me sekuenca të pasura me prolinë në proteina të tjera).
Motivi i sekuencës
[Redakto | Redakto nëpërmjet kodit]Sekuencat e shkurtra të aminoacideve brenda proteinave shpesh veprojnë si vende njohjeje për proteinat e tjera.[40] Për shembull, domenet SH3 zakonisht lidhen me motive të shkurtra PxxP (d.m.th. 2 prolina [P], të ndara nga dy aminoacide të paspecifikuara [x], megjithëse aminoacidet përreth mund të përcaktojnë specifikën e saktë të lidhjes). Shumë motive të tilla janë mbledhur në bazën e të dhënave Eukariote Linear Motif (ELM).

Funksionet qelizore
[Redakto | Redakto nëpërmjet kodit]Proteinat janë aktorët kryesorë brenda qelizës, që thuhet se kryejnë detyrat e specifikuara nga informacioni i koduar në gjene. Me përjashtim të disa llojeve të ARN-së, shumica e molekulave të tjera biologjike janë elementë relativisht inertë mbi të cilët veprojnë proteinat. Proteinat përbëjnë gjysmën e peshës së thatë të një qelize Escherichia coli, ndërsa makromolekulat e tjera si ADN dhe ARN përbëjnë përkatësisht vetëm 3% dhe 20%. Grupi i proteinave të shprehura në një qelizë ose lloj qelize të caktuar njihet si proteoma e saj.
Enzima heksokinaza tregohet si një model molekular konvencional me top dhe shkop. Për shkallë në këndin e sipërm djathtas janë dy nga nënshtresat e tij, ATP dhe glukoza.
Karakteristika kryesore e proteinave që lejon gjithashtu grupin e tyre të larmishëm të funksioneve është aftësia e tyre për të lidhur molekulat e tjera në mënyrë specifike dhe fort. Rajoni i proteinës përgjegjëse për lidhjen e një molekule tjetër njihet si vendi i lidhjes dhe shpesh është një depresion ose "xhep" në sipërfaqen molekulare. Kjo aftësi lidhëse ndërmjetësohet nga struktura terciare e proteinës, e cila përcakton xhepin e vendit të lidhjes, dhe nga vetitë kimike të vargjeve anësore të aminoacideve përreth. Lidhja e proteinave mund të jetë jashtëzakonisht e ngushtë dhe specifike; për shembull, proteina frenuese e ribonukleazës lidhet me angiogjeninën njerëzore me një konstante disociimi sub-femtomolar (<10−15 M), por nuk lidhet fare me onkonazën e saj homologe amfibe (>1 M). Ndryshimet kimike jashtëzakonisht të vogla si shtimi i një grupi të vetëm metil tek një partner lidhës ndonjëherë mund të mjaftojnë për të eliminuar pothuajse lidhjen; për shembull, aminoacil tRNA sintetaza specifike për aminoacidin valin diskriminon zinxhirin anësor shumë të ngjashëm të aminoacidit izoleucinë.
Proteinat mund të lidhen me proteina të tjera, si dhe me substrate me molekula të vogla. Kur proteinat lidhen në mënyrë specifike me kopje të tjera të së njëjtës molekulë, ato mund të oligomerizohen për të formuar fibrile; ky proces ndodh shpesh në proteinat strukturore që përbëhen nga monomere globulare që vetë-shoqërohen për të formuar fibra të ngurtë. Ndërveprimet protein-proteinë rregullojnë gjithashtu aktivitetin enzimatik, kontrollojnë përparimin përmes ciklit qelizor dhe lejojnë grumbullimin e komplekseve të mëdha proteinike që kryejnë shumë reaksione të lidhura ngushtë me një funksion të përbashkët biologjik. Proteinat gjithashtu mund të lidhen ose madje të integrohen në membranat qelizore. Aftësia e partnerëve lidhës për të nxitur ndryshime konformacionale në proteina lejon ndërtimin e rrjeteve sinjalizuese jashtëzakonisht komplekse. Meqenëse ndërveprimet ndërmjet proteinave janë të kthyeshme dhe varen shumë nga disponueshmëria e grupeve të ndryshme të proteinave partnere për të formuar agregate që janë të afta të kryejnë grupe funksionesh diskrete, studimi i ndërveprimeve midis proteinave specifike është një çelës për të kuptuar aspekte të rëndësishme të funksionit qelizor. , dhe në fund të fundit vetitë që dallojnë lloje të veçanta të qelizave.
Enzimat
[Redakto | Redakto nëpërmjet kodit]Roli më i njohur i proteinave në qelizë është si enzima, të cilat katalizojnë reaksionet kimike. Enzimat zakonisht janë shumë specifike dhe përshpejtojnë vetëm një ose disa reaksione kimike. Enzimat kryejnë shumicën e reaksioneve të përfshira në metabolizëm, si dhe manipulojnë ADN-në në procese të tilla si riprodhimi i ADN-së, riparimi i ADN-së dhe transkriptimi. Disa enzima veprojnë në proteina të tjera për të shtuar ose hequr grupe kimike në një proces të njohur si modifikim posttranslativ. Rreth 4,000 reaksione dihet se katalizohen nga enzimat. Përshpejtimi i shpejtësisë që jepet nga kataliza enzimatike është shpesh i madh - deri në 1017-fish rritje në shpejtësi ndaj reaksionit të pakatalizuar në rastin e dekarboksilazës orotate (78 milionë vjet pa enzimën, 18 milisekonda me enzimën).
Molekulat e lidhura dhe mbi të cilat veprojnë enzimat quhen substrate. Edhe pse enzimat mund të përbëhen nga qindra aminoacide, zakonisht është vetëm një pjesë e vogël e mbetjeve që vijnë në kontakt me substratin dhe një fraksion akoma më i vogël - mesatarisht tre deri në katër mbetje - që përfshihen drejtpërdrejt në katalizë. Rajoni i enzimës që lidh substratin dhe përmban mbetjet katalitike njihet si vend aktiv.
Proteinat dirigent janë anëtarë të një klase proteinash që diktojnë stereokiminë e një përbërjeje të sintetizuar nga enzima të tjera.
Proteinat në trupin e njeriut
[Redakto | Redakto nëpërmjet kodit]Nevojat ditore varen nga pesha : llogaritet 0.8-0.9 gr për 1 kilogram të peshës në ditë, me ndryshime në bazë të rëndësisë së aktivitetit muskulor. Për bodybuilding nevojat janë mesatarisht 1.5-2gr për kilogram,në ditë:
Pesha juaj Proteina gjatë ditës (faktori 1.8g/kg/ditë
- 45kg 81 gr në ditë
- 50kg 90 gr në ditë
- 55kg 99 gr në ditë
- 60kg 108 gr në ditë
- 65kg 117 gr në ditë
- 70kg 126 gr në ditë
- 75kg 135 gr në ditë
- 80kg 144 gr në ditë
- 85kg 153 gr në ditë
- 90kg 162 gr në ditë
Nevoja për proteina ndryshon sipas: moshës, gjinisë, (gratë kanë më pak nevojë pasi që masa e tyre muskulore është më e vogël).Këto nevoja ditore plotësohen duke konsumuar dy ose tri here në ditë ushqim me origjinë kafshësh ose bimësh të pasur me proteinë.
Ekzistojnë më tepër se 10000 proteina
[Redakto | Redakto nëpërmjet kodit]Proteinat me prejardhje bimore:Këto proteina janë prezente në bishtaja (soja,qiqër etj.). Proteinat me origjinë bimore nuk kanë të gjitha aminoacidet esenciale (përveç sojës). Proteinat me prejardhje nga kafshët: Këto përmbajnë të gjitha aminoacidet e domosdoshme,dhe i gjejmë në mish, peshq, vezë dhe prodhime qumështi. Proteinet me prejardhje nga kafshët duhet të konsumohen çdo ditë për të plotësuar nevojat me aminoacide të domosdoshme. Proteinat "e nxjerrura": vinë nga vezët dhe nga soja, këto janë burimet e amino-acideve të kualitetit më të mirë.
Tri burime kryesore te gatshme:
Nga i bardhi i vesë, kazeina dhe whey (hirra), kjo e fundit është më e njohur nga bodybuilder-ët.
Këto prodhime ofrojnë përparësinë të ofrojnë proteinën pa materie yndyrore apo kaloritë që i shoqërojnë këto materie. Proteina Whey
Whey është një proteinë e lactoserum-it, me prejardhje nga hirra (lactoserum), ideale për ta ndaluar katabolizmin (shkatërrimin e muskujve).
Ajo tretet shpejtë nga organizmi. Ky burim i proteinave është i pasur me glutaminë. Është gjithashtu edhe një burim i shkëlqyeshëm i amino-acideve të Degëzuara (ose në angl. BCAA Branched Chains Amino Acids),të domosdoshëm për rikuperimin e rritjes muskulore. Një proteinë që nuk preferohet të merret para se të flemë pasi që nuk shpërndan gjatë kohë amino acide në trup.
Në këtë rast preferohet kazeina ose proteina e vesë.Në mbrëmje: Së paku 3 orë pas darkës. Përzihet me qumësht(gjysmë yndyror ose me 0% yndyrë),eventualisht me qumësht nga soja, lëng portokalli(lëshon një sekrecion që është i dobishëm për tretjen e proteinave nga organizmi (por të shmanget marrja në mbrëmje))Nga 1.8 deri në 2 g proteine për kilogram të peshës trupore të ndarë në 4-5 ngrënie.Kujdes, shumë Whey të shitur në treg përmbajnë më tepër përbërës (amino-acide, glutaminë, kreatinë etj), lexoni mirë përbërjen që të evitoni mbidozimin.
Në disa raste Whey komplet mund të ju kursejnë para ngase nuk duhet të bleni përbërës tjerë ndaras.
Vetitë
[Redakto | Redakto nëpërmjet kodit]Vetitë e proteinave lidhen me vetitë e përbërësve të tyre, aminoacideve: janë elektrolite amfotere. Për të matur peshën molekulare të proteinave duhen përdorur teknika mjaft të vështira një ndër të cilat është spektometria e masës. Proteinat janë komponime amofotere. Proteinat, në përgjithësi, nuk treten mirë në ujë, por formojnë tretësira koloideale, gjë që është në pajtim me natyrën e molekulave të tyre. Disa prej tyre treten në ujë(p.sh e bardha e vesë), ndërsa disa të tjerë në tretësira të holluara të acideve, bazave ose të kripërave të holluar.